博文
559专栏 细胞治疗、再生医疗,中日监管方式(2)
大阪市TPC市场调研公司于2018年11月30日发布的最新调查报告显示,2017财年度日本再生医疗相关产品和服务的市场规模,较上一年增加20.0%,到390亿日元。市场增长的一个关键因素是,新药研发和既有药物新适应症拓展过程中对关联消耗品、生产设备、运输服务等周边产业的需求增大。
2018年以来市场规模继续保持扩大态势,预计2020年将达到660亿日元,2030年到3600亿日元规模。尤其是iPS细胞研究十年来,成果渐渐隐现,近期频频走进临床。器官移植、慢性病等领域的细胞治疗产品上市明显加速。与此同时,对研发、生产用仪器,以及合同外包研发(Contract Research Organization, CRO)和生产(Contract Manufacturing Organization, CMO)等服务的需求预计也将迅速增长。
2013年以后,化药制造商等外部企业也都纷纷进入再生医疗领域。随着再生医疗和细胞治疗市场的逐步扩大,国家和地方政府也正在积极加强对再生医疗研究开发和初创企业等的支持力度。
下面我们来详细了解一下日本对于再生医疗和细胞治疗领域的监管机构及相关法律法规。
日本再生医疗领域的主要国家监管部委为:厚生劳动省、经济产业省、文部科学省、医药品医疗器械综合机构(PMDA)。四个机关单位在研究推动、设计开发、许可认定、品质评价、程序审查等具体事务上各有侧重和分工协作,另外日本规格协会(JSA)负责安全性评价等行业标准制定(图1)。
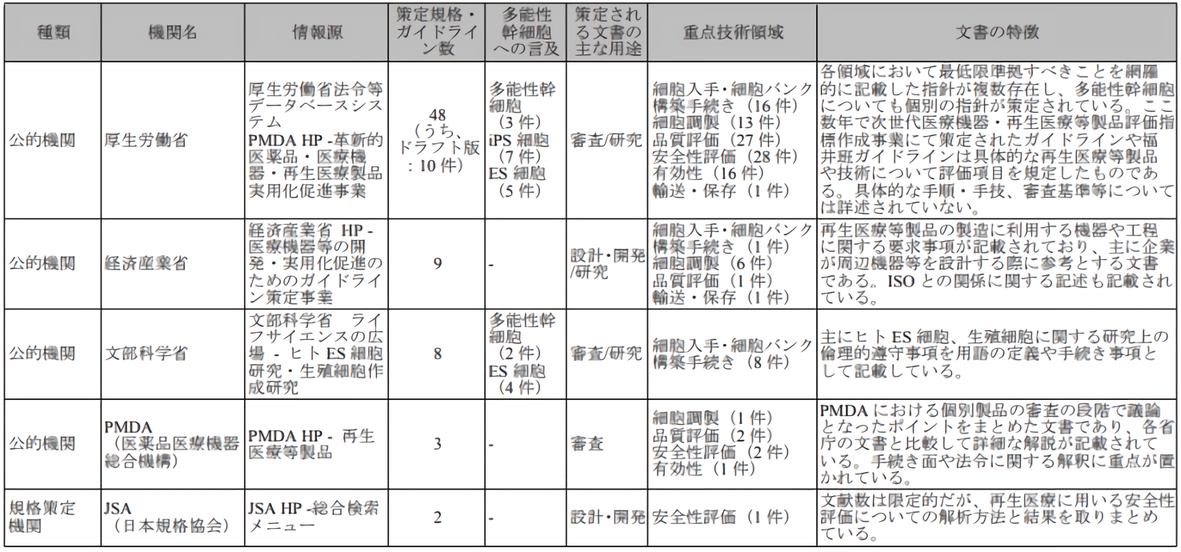
图1 日本再生医疗主要监管部门 [出处:参考文献1]
再生医疗创新论坛(FIRM)、日本再生医疗学会、京都大学iPS细胞研究所(CiRA)等主要相关机构也在细胞采集、制备、运输、保存等具体技术层面上都制定了业内指导文件(图2)。
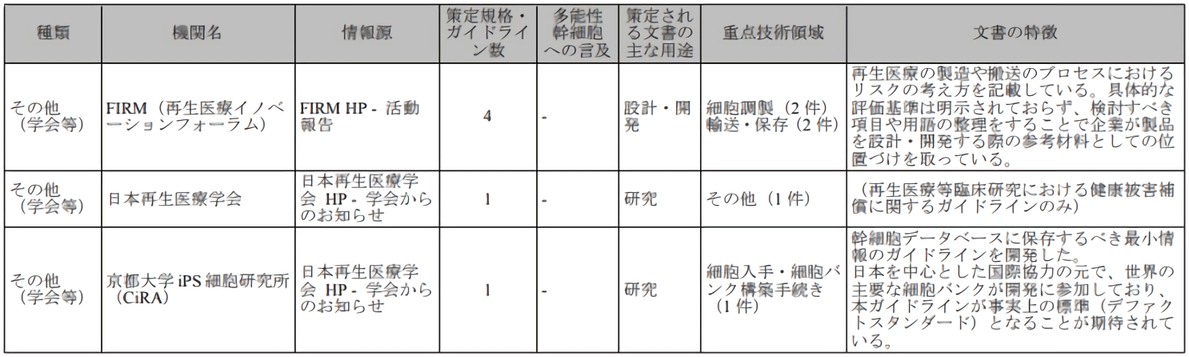
图2 日本再生医疗主要协会机构 [出处:参考文献1]
2010年以来,经济产业省主要对细胞培养相关设备及工艺流程等方面制定了一些指导方针。近年,厚生劳动省主导制定的法规较多,针对不同的疾病领域、细胞类型等都分门别类地做了详细规定,也是评估审查的主要参照标准(图3)。
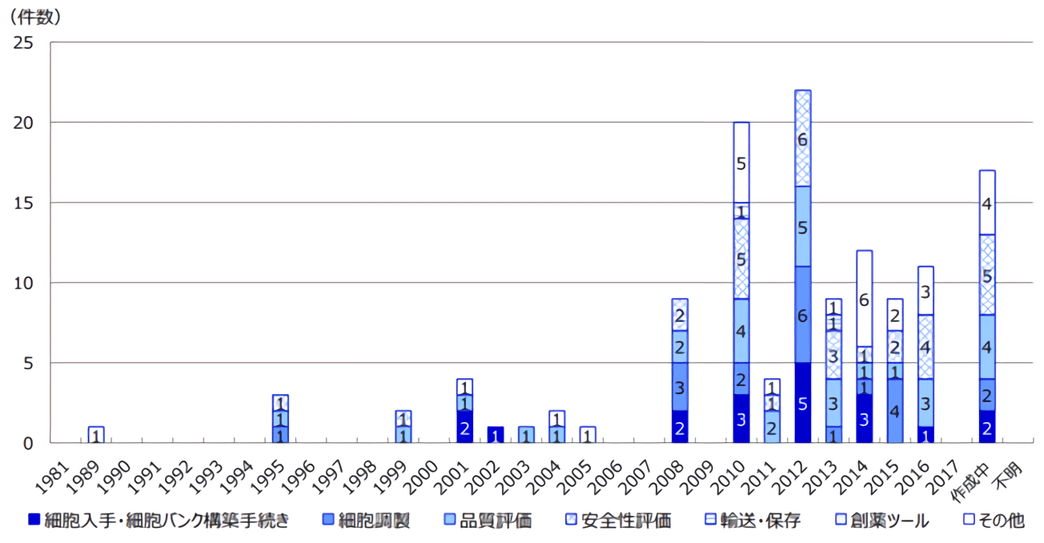
图3 日本再生医疗领域相关法规实施年代表 (图出处:三菱综合研究所)
2014年11月,《再生医疗安全确保法》、《医药品和医疗器械品质、有效性及安全性确保法》(《药械法》)等新的法律框架正式实施以来,再生医疗临床和上市审批周期都大大加快(图4),更多的企业和研究机构进入再生医疗领域,研究成果涌现,临床试验数量激增,再生医疗产业进入活跃期[1]。
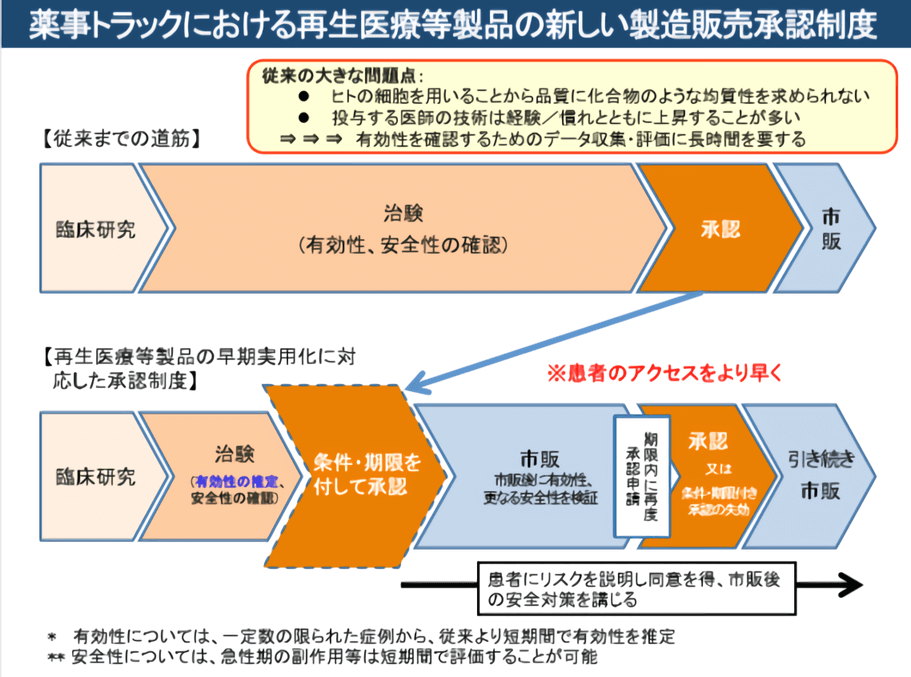
图4 日本新法规下药品审批流程加快 (图出处:佐藤阳治/NIHS)
根据不同细胞疗法对患者带来的潜在风险不同,审批程序也不一样(图5)。比如通过体外活化自体淋巴细胞回输的常规LAK或ANK免疫细胞疗法归为低风险的第三类再生医疗;用自体脂肪干细胞丰胸等属于中度风险的第二类再生医疗;而进行体外基因操作后再回输的CAR-T疗法列为风险最高的第一类再生医疗。
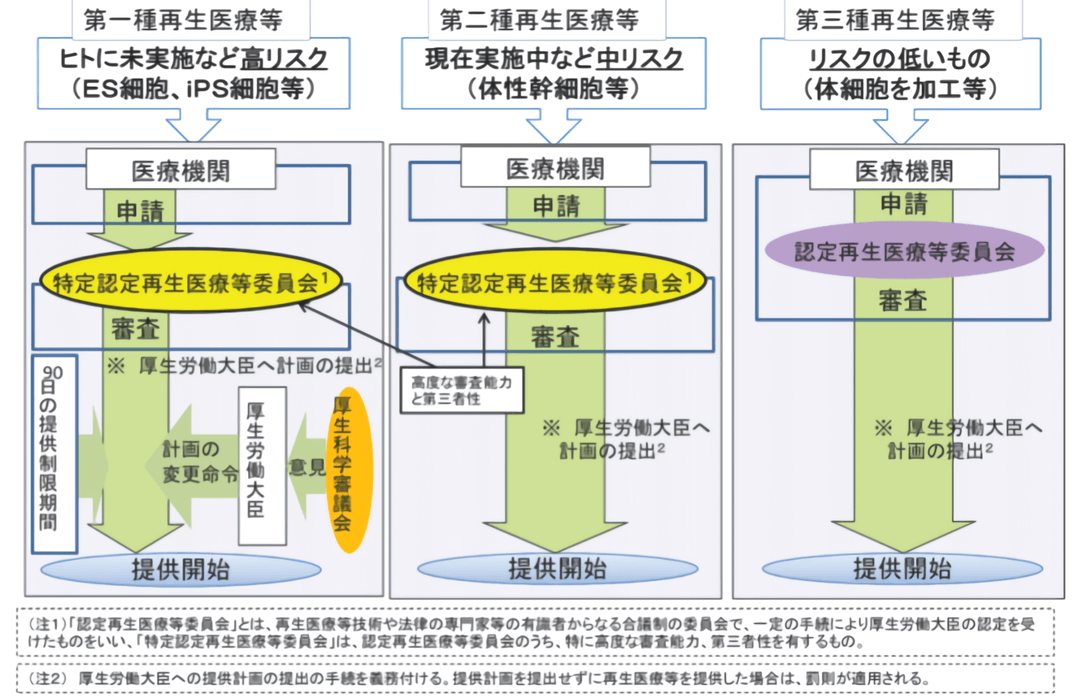
图5 再生医疗风险等级分类 (图出处:佐藤阳治/NIHS)
整体来讲,仅是在诊所或医院等机构内部实施的免疫细胞采集和治疗,以及研究者发起的临床试验,属于《再生医疗安全确保法》的管辖范畴。如果有第三方企业等介入免疫细胞的基因操作、加工制备、生产销售等,则涉及《药械法》(修订后的《药事法》)(图6)。
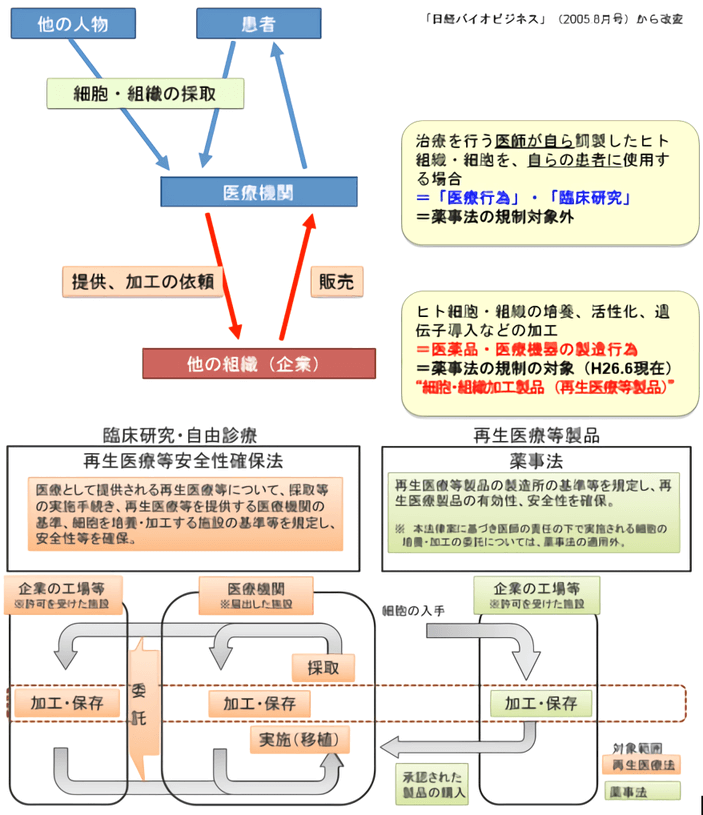
图6 新法规下的再生医疗监管 (图:佐藤阳治/NIHS)
供稿 宋傑 东京大学博士
免责声明:本文中使用的图片均由博主自行发布,与本网无关,如有侵权,请联系博主进行删除。




